El hidrógeno es percibido por gran parte de la sociedad como peligroso y en ello ha tenido mucho que ver las impactantes imágenes del Hindelburg en llamas sobre Nueva Jersey. Esas poderosas fotografías se han colado en el imaginario colectivo haciendo que se genere un gran rechazo, en gran medida irracional, hacia el hidrógeno y sus aplicaciones. No hay conversación a nivel social (familia y amigos) en la que salga el hidrógeno y a continuación no se mencione el conocido dirigible y los riesgos del hidrógeno. Sin embargo, durante el último siglo se ha producido y utilizado hidrógeno para una amplia gama de fines industriales y comerciales, y todo ello con unos elevados niveles de seguridad. Si bien es verdad que en estas aplicaciones el hidrógeno no llega finalmente al usuario como tal, sino que este se emplea para llevar a cabo otros procesos o producir otras sustancias. Lo que el usuario teme es el estar expuesto al hidrógeno en primera persona lo cual podría tener lugar, por ejemplo, con el creciente uso de los vehículos de pila de combustible. Así pues, ¿es el hidrógeno tan peligroso? Vamos a intentar arrojar algo de luz sobre las tinieblas que rodean a la supuesta peligrosidad del hidrógeno.
Características del hidrógeno
Obviamente, todo combustible o vector energético presenta una serie de riesgos intrínsecos si no se maneja de forma apropiada, y el hidrógeno no es menos. Por ello, la peligrosidad o el riesgo que entraña el uso del hidrógeno debe medirse por comparación con la peligrosidad que suponen el uso de otros combustibles mucho más normalizados por la sociedad como pueden ser el gas natural, la gasolina, el gasóleo o el butano. Vayamos comparando una a una diferentes propiedades de los combustibles.
Fugas
La molécula del hidrógeno es la más pequeña, mucho menor que la de otros combustibles, por lo que el hidrógeno presenta una mayor tendencia que otros combustibles a fugarse o escaparse por pequeñas aberturas u orificios. Teniendo en cuenta tanto la densidad como la viscosidad y el coeficiente de difusión en el aire del hidrógeno se llega a la conclusión de que la propensión del hidrógeno a fugarse por juntas u orificios en líneas de baja presión es entre 1.26 y 2.8 veces superior a la del gas natural a través del mismo orificio. Sin embargo, la densidad de energía del gas natural es tres veces superior a la del hidrógeno, lo que conduce a que en una fuga de gas natural se libere una mayor cantidad de energía que en una fuga de hidrógeno. En el caso de fugas producidas en tanques de alta presión, la velocidad de escape está limitada por la velocidad del sonido en el gas fugado. Así, la velocidad del sonido en el hidrógeno es 1308 m/s mientras que en el gas natural es 449 m/s. Teniendo en cuenta nuevamente que la densidad de energía del gas natural es tres veces mayor, la fuga de gas natural contendrá en este caso una energía ligeramente mayor que la de hidrógeno.
Densidad y difusión
El hidrógeno cuenta con un factor que reduce de forma significativa su peligrosidad en espacios abiertos, y es que es mucho más ligero que el aire y que el resto de los combustibles como puede verse en la Tabla 1. Además, presenta una difusión mucho más rápida que el resto de los combustibles. Así, si se produce una fuga de hidrógeno por cualquier motivo, este se elevará y dispersará rápidamente en la atmósfera, mucho más rápidamente que el resto de los combustibles. De hecho, combustibles a los que estamos muy acostumbrados como la gasolina, el propano o el butano tienen una mayor densidad que el aire, de tal forma que en caso de fuga se acumulan a nivel del suelo lo que puede derivar en situaciones de gran peligrosidad en caso de ignición. Pensemos por ejemplo en un automóvil, en caso de emplear depósitos de hidrógeno a alta presión, si se produce una fuga con llama esta ascenderá rápidamente. Sin embargo, en el caso de la gasolina o el propano, sus vapores arderán a ras de suelo y debajo del vehículo generando una situación de gran peligro pudiendo derivar en el incendio del vehículo completo. Este ensayo con un vehículo con hidrógeno y otro con gasolina fue llevado a cabo por investigadores de la Universidad de Miami, la secuencia obtenida se muestra en la Figura 1. Puede apreciarse que el vehículo de gasolina sufre severos daños en un corto espacio de tiempo, mientras el de hidrógeno permanece prácticamente intacto. Esto no quiere decir que el uso de gasolina entrañe un gran riesgo, su uso diario desmiente ese supuesto, más bien pone de manifiesto que el hidrógeno no es tan peligroso o al menos no más que la gasolina en este caso.

Figura 1. Secuencia de imágenes tomadas durante el estudio comparativo de fuga con llama de un vehículo de hidrógeno y un vehículo de gasolina.
El hidrógeno presenta una molécula tan pequeña y se difunde tan bien que puede difundirse y reaccionar incluso con metales, debilitándolos y dando lugar a la denominada fragilización por hidrógeno. De ahí que sea tan importante la elección de materiales adecuados para trabajar con hidrógeno.
Intervalo de inflamabilidad
Se denomina límites de inflamabilidad al intervalo de concentraciones combustible-aire en los cuales se puede llevar a cabo la combustión. Estos límites pueden variar con la presión y la temperatura, pero habitualmente se presentan como datos en porcentaje en volumen a 25 °C y presión atmosférica. Como puede verse en la Tabla 1, el hidrógeno presenta el intervalo de inflamabilidad más amplio, únicamente superado por el acetileno. Sin embargo, la practicidad de los intervalos de inflamabilidad es limitada. En el ámbito de la seguridad suele ser más interesante el límite inferior de inflamabilidad que es el que determina a partir de que punto una fuga será inflamable. Atendiendo a este límite, el límite inferior del hidrógeno es muy superior al de la gasolina, el gasóleo, el butano y el propano y algo menor que el del metano.
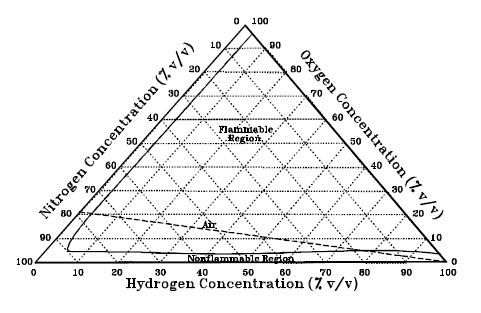
Figura 2. Diagrama ternario que representa el límite de inflamabilidad de las distintas composiciones de hidrógeno, nitrógeno y oxígeno, entre ellas el aire.
Energía de ignición
La energía de ignición para la mezcla estequiométrica de hidrógeno es muy pequeña, en torno a 0.02 mJ, un orden de magnitud menor que la del resto de combustibles. Sin embargo, la mezcla estequiométrica del hidrógeno con el aire es de un 29% en volumen de hidrógeno, lo que, en principio, será bastante improbable cuando tenga lugar una fuga ya que antes de alcanzar esa concentración el hidrógeno habrá ascendido y se habrá difundido en la atmosfera (en lugares abiertos). Por tanto, la energía de ignición de la relación estequiométrica del hidrógeno no nos transmite demasiada información. La energía de ignición es función de la relación combustible-aire, y resulta que en el límite inferior de inflamabilidad del hidrógeno, un punto más representativo, su energía de ignición es del mismo orden que la del gas natural.
Temperatura de autoignición
La temperatura mínima a la que un combustible, a presión de una atmósfera, en contacto con el aire arde de forma espontanea sin necesidad de una fuente de calor se la conoce como temperatura de autoignición. La temperatura de autoignición es dependiente de la presión y concentración del hidrógeno así como de la naturaleza del depósito, por lo que no hay un consenso único sobre su valor. Aun así, como puede verse en la Tabla 1, la temperatura de autoignición del hidrógeno es muy superior a la de la de la gasolina y el gasóleo, algo superior a la del butano y el propano e igual a la del gas natural. Así pues, será más complicado que se produzca la combustión en ausencia de una fuente de ignición en el caso del hidrógeno que en el de la gasolina o el gasóleo, por ejemplo. Sin embargo, dicha temperatura de autoignición puede verse reducida en presencia de un catalizador de la reacción.
Llama del hidrógeno
A la luz del día, las llamas de hidrógeno son prácticamente invisibles a simple vista lo cual aumenta su peligrosidad ya que la gente que pueda encontrarse alrededor de la llama puede no darse cuenta de su presencia, véase Figura 3. Es posible que algunas impurezas presentes en el aire, tales como el sodio en zonas costeras, induzcan una cierta coloración a la llama, pero aún así, es muy complicada de ver. El problema de la visibilidad de la llama del hidrógeno podría resolverse añadiendo productos químicos que confieran una luminosidad adecuada. Sin embargo, en el caso de pilas de combustible de baja temperatura, como son las que se están empleando actualmente en automoción, el hidrógeno suministrado tiene que ser de gran pureza para evitar la contaminación de los electrodos. Así, la adición de algún producto químico al hidrógeno presenta una serie de inconvenientes. Como puede verse en la Figura 3, por la noche la llama sí presenta un cierto brillo. Aun así, sigue siendo difícil de ver y mucho más pálida que las llamas del resto de combustibles. Además, el hidrógeno per se es incoloro e inodoro, por lo que no es posible detectar su presencia mediante los sentidos.

Figura 3. Comparación de la luminosidad de las llamas de propano e hidrógeno de día y de noche.
Radiación infrarroja y ultravioleta
Las llamas de hidrógeno presentan una baja emisividad, o lo que es lo mismo, una baja irradiación en el infrarrojo. Esto hace que disminuya la probabilidad de que el fuego se propague a los objetos y personas circundantes debido a la transferencia de calor radiada. No obstante, esta baja emisividad también implica que al estar cerca de una llama de hidrógeno hay poca sensación de calor, lo que puede conducir a un contacto inadvertido con la misma.
Aunque emiten muy poco en el espectro infrarrojo, las llamas de hidrógeno irradian una gran cantidad de radiación ultravioleta. De tal manera que una persona que este cerca de una llama de hidrógeno experimentará poca sensación de calor debido a la baja emisividad en el infrarrojo, pero estará recibiendo una cantidad considerable de radiación ultravioleta lo que puede derivar en quemaduras solares si hay una sobreexposición.
Velocidad de llama y detonación
La velocidad de llama del hidrógeno es mucho más rápida que la del gas natural o la gasolina, de manera que en principio es más probable que una llama de hidrógeno derive en una detonación. La velocidad subsónica de combustión del hidrógeno en aire en condiciones ambiente y con mezcla estequiométrica es de 2.55 m/s alcanzando una velocidad máxima de 3.2 m/s en una concentración de 40.1 %, llegando hasta 11.75 m/s en oxígeno puro. Sin embargo, en una atmósfera abierta la probabilidad de que tenga lugar una detonación de hidrógeno es pequeñísima. Como hemos mencionado antes, el hidrógeno es un gas muy ligero y se difunde muy rápidamente lo que impediría que se alcanzasen mezclas suficientemente ricas como para que tuviese lugar la detonación. Además, como puede verse en la Tabla 1, el límite inferior de detonación de la mezcla hidrógeno-aire es de un 13% en volumen, 2 veces superior al del metano y 12 veces más que el de la gasolina. Por tanto, una detonación en un espacio confinado tendría lugar bajo supuestos poco probables. Esto es, el hidrógeno en primer lugar debería acumularse en ausencia de una fuente de ignición hasta alcanzar un volumen respecto al aire superior al 13%. Llegados a este punto debería aparecer una fuente de ignición que desencadenase la reacción. A pesar de la baja probabilidad de que esta secuencia de hechos tenga lugar, aquellos habitáculos en los que haya presencia de dispositivos que empleen hidrógeno deben estar diseñados con una ventilación adecuada de manera que se impida que las mezclas alcancen proporciones peligrosas. Con todo, la energía explosiva del hidrógeno por unidad de volumen es 3.5 veces menor que la del metano y 22 veces inferior a la del vapor de la gasolina.
Es necesario indicar que los límites de detonación son notablemente dependientes de la naturaleza y dimensiones del confinamiento, por lo que los datos expuestos en la Tabla 1 a este respecto son orientativos.
Toxicidad y productos de combustión
A diferencia de otros combustibles, el hidrógeno, aunque puede producir asfixia, no es tóxico. Además, mientras que la combustión de combustibles tales como la gasolina producen humo y hollín que pueden resultar peligrosos para la salud, la combustión del hidrógeno produce únicamente agua como producto, a no ser que ardan durante el proceso otro tipo de elementos.
Seguridad del hidrógeno
Como se mencionó al principio, todo combustible presenta una serie de riesgos si no se maneja de forma apropiada. Así, a la vista de las características mostradas, es necesario adoptar una serie de medidas de seguridad a fin de minimizar el riesgo derivado de ciertas características del hidrógeno. Gran parte de las medidas sugeridas hacen referencia a la automoción que en el estado actual de desarrollo de las tecnologías del hidrógeno es probablemente la aplicación en que el hidrógeno es más cercano al usuario. También existen protocolos derivados de la producción de hidrógeno, el almacenamiento y su utilización en lugares confinados.
Vehículos
Una liberación de hidrógeno por parte de un vehículo en una atmósfera abierta, como se ha mencionado antes, entraña un riesgo menor que si fuese otro el combustible liberado. Sin embargo, hay que evaluar el riesgo en todas las posibles situaciones en las que el vehículo pueda encontrarse, así como todas las posibles fuentes de riesgo, desde el depósito, pasando por las conducciones hasta la pila de combustible.
Aunque en la pila de combustible el hidrógeno y el oxígeno están separados por unas delgadas membranas, el riesgo potencial que supone es muy limitado. Si una de dichas membranas se rompiese, lo que sería de por sí raro, el hidrógeno y el oxígeno se mezclarían lo que daría lugar a una pérdida inmediata de la potencia proporcionada por la pila de combustible. Esta sería detectada por el sistema de control que cerraría y desconectaría las líneas de suministro de hidrógeno. La temperatura a la que se encuentra la pila de combustible, en el caso de los vehículos suelen tratarse de pilas de combustible PEM (Proton Exchange Membrane) operando a entre 60 °C y 90 °C, no es suficiente como para actuar como fuente de la ignición. Aun así, el hidrógeno y el oxígeno pueden reaccionar sobre la superficie de los catalizadores y crear condiciones de ignición. Sin embargo, el potencial riesgo es muy pequeño debido a la pequeña cantidad de hidrógeno presente en el interior de la pila de combustible.
Los vehículos propulsados por pila de combustible de hidrógeno cuentan con una serie de detectores de hidrógeno, si se detectase una presencia de hidrógeno superior a un cierto umbral se procedería al cierra automático de los depósitos de hidrógeno. De igual forma, si el flujo de combustible excede el utilizado por el stack o es inferior al demandado, indicativo de un posible fallo, se produce también el cierre y desconexión de los depósitos. Además, en caso de que el sistema detecte algún tipo de fallo en el suministro del combustible, se produce el apagado inmediato y automático de las baterías ya que podrían actuar como foco de ignición. De hecho, es una buena práctica durante el diseño de los vehículos de pila de combustible que las líneas de suministro de hidrógeno estén lo más separadas posibles de las partes eléctricas.
El punto más crítico de un vehículo de pila de combustible por ser en el que se encuentra la mayor parte del hidrógeno son los tanques con hidrógeno presurizado. Sin embargo, dichos tanques son extremadamente robustos (ver Almacenamiento de hidrógeno comprimido: tipos de tanques) y son sometidos a un gran número de pruebas para asegurar su fiabilidad. Una de las más vistosas es el estudio del comportamiento del depósito ante un disparo, véase el video. Como puede apreciarse, el disparo no deriva en una ruptura explosiva y catastrófica del tanque. Además, como elemento de seguridad cada tanque de combustible cuenta con su propia válvula de alivio de presión que ventea automáticamente el contenido en caso de un aumento excesivo de la temperatura.
Espacios confinados
El mayor riesgo del hidrógeno deriva de su presencia en lugares confinados donde puede producirse la acumulación del gas con el consiguiente riesgo asociado. Por ello, es esencial contar con una red de detectores de hidrógeno que puedan alertar de forma temprana de la presencia del gas para tomar las medidas adecuadas. Es muy importante disponer los detectores de hidrógeno de forma adecuada en el espacio para lo que es preciso realizar un estudio pormenorizado de la instalación. Las alarmas deben activarse en dos posibles umbrales. Cuando el contenido de hidrógeno alcanza un 25% del límite inferior de detonación y cuando alcanza el 60% de dicho límite momento en el cual pueden llevarse a cabo acciones automáticas tales como apagados de sistemas para evitar focos de ignición o encendido de la ventilación forzada.
Es crucial contar con un buen sistema de ventilación en aquellos espacios confinados en los que pueda haber presencia de hidrógeno. Este tipo de sistemas permite controlar una atmósfera peligrosa mediante la renovación de la misma. Así, el riesgo en garajes puede minimizarse sustancialmente contando con un sistema de detección de hidrógeno y una ventilación adecuada.
Conclusiones
El hidrógeno como cualquier otro combustible presenta una serie de riesgos. Sin embargo, estos pueden ser minimizados con un manejo apropiado e implementando las medidas de seguridad adecuadas, como con cualquier otro combustible. En la mayor parte de aplicaciones el hidrógeno no entraña un riesgo mayor que otros combustibles normalmente utilizados. De hecho, sus características particulares hacen que en muchos casos su uso pueda ser hasta más seguro. Para que un vehículo de pila de combustible en operación tenga un accidente severo en relación con el hidrógeno es necesario que ocurran de forma simultanea varios fallos, lo que es altamente improbable.
Referencias
Dispelling Common Hydrogen Safety Myths
Barbir F. PEM fuel cells: theory and practice. 2nd ed. Amsterdam: Elsevier Academic Press; 2013.
Najjar, Yousef SH. «Hydrogen safety: The road toward green technology.» International Journal of Hydrogen Energy 38.25 (2013): 10716-10728.
Initial Guidance for Using Hydrogen in Confined Spaces – Results from InsHyde
Swain, Michael R. «Fuel leak simulation.» In Proceedings of the 2001 DOE Hydrogen Program Review, NREL/CP-570-30535. 2001.




Mmmm, lo de la comparativa entre los dos coches con una fuga de los depósitos… Me parece un poco tramposo… Me explico. ¿Por qué la fuga del vehículo de hidrógeno se tiene que producir justo donde se ve en las imágenes? Un depósito de combustible, ya sea de gasolinas, gasóleos, hidrógeno o lo que sea.., no se va a romper espontáneamente… Un depósito de combustible se rompe o tiene fugas cuando se produce una colisión, un vuelco, etc. Suponer que va a salir un poro en el depósito justo donde se ve en la imagen de forma espontánea es, sencillamente, irreal y no demuestra absolutamente nada. Y eso sin mencionar el coste que se requiere para construir un depósito de hidrógeno y uno de combustible convencional… Aparte que hay vehículos como el Honda Civic de la generación de 2012-2016 que llevaba el depósito (que además creo que es plástico) bajo el asiento del copiloto que es una de las zonas más protegidas en un vehículo y menos susceptibles de verse afectada en caso de accidente.
La cuestión es… En caso de un accidente si el poro y la llamarada surgieran hacia el habitáculo y no encima del maletero hacia el cielo… ¿Esa llama podría incendiar un vehículo? ¿Habría riesgo de explosión llegado el caso?
Me ha parecido muy interesante el blog. Muchas gracias.
Excelente estoy en un proyecto quiero aprender mas del tema
Sin embargo, el que el color de la flama no sea visible, representa un riesgo muy alto al poderse producir quemaduras severas por su «invisibilidad», lo cual, tal vez, pudiera ser controlado con lentes que pudieran hacer visible esta flama.
Trabaje en un Horno Alto , como profesional en instrumentación, las experiencias con el H2
Son de con secuencias terribles , leí el artículo y en las comparaciones con otros gases, ustedes arriman el ascua a su sardina , y desde el punto de usuario de automóviles lo veo muy peligroso y con muchas medidas de seguridad que encarecerian el vehículo. El almacenamiento cerca de las zonas habitadas tendrá muchísimos inconvenientes, creo que tendían que explicarlo más claro y compresible para el ciudadano de conocimiento menores. Gracias .